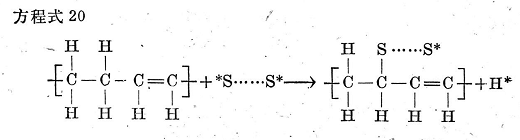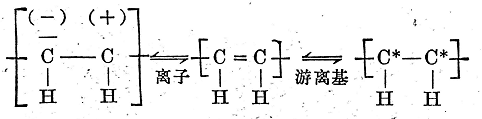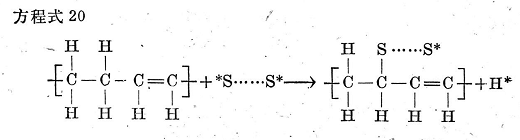2.2.2.2橡膠鏈的反應性
在硫化過程中,在初步反應中�����,橡膠分子也要產(chǎn)生變化而轉(zhuǎn)化為比較易于進行交聯(lián)反應的形式。為了便于理解反應的可能性���,首先講一講可用硫黃進行硫化的橡膠結(jié)構���。
天然橡膠和其它能用硫黃硫化的橡膠的反應性是由其高分子烴不飽和性所致。因此可以認為��,橡膠高分子鏈在硫黃硫化中的初步反應是在雙鍵或與其相鄰的α-次甲基上進行的����。α-次甲基的反應性是由于接近雙鍵而引起的�����。
與只有一對電子所形成的簡單的無極鍵相比����,在鏈烯雙鍵中,有第二對電子重疊到基本電子對上�����。第二對電子(即所謂π電子)使C=C鍵的反應性比較高。根據(jù)最新的標記方法��,用一長劃代表一個電子對�����,而用一點或一個星號表示單個電子�����,一個雙鍵的反應可能性可用下列中介平衡表示(見方程式15)�����。
方程式15
上式表明��,雙鍵并非總處于穩(wěn)定狀態(tài)���,而由于受外界離子化或游離基化的影響,它可以轉(zhuǎn)化為方程式15兩端的結(jié)構�。由于這種轉(zhuǎn)化僅僅是由于電子云的變形引起的,所以兩端的結(jié)構代表的仍是同一種物質(zhì)�����。
如果鏈烯烴受到離子化的作用,π電子對就全部轉(zhuǎn)移到個碳原子上�����,這一碳原子就帶負電荷,另外一個碳原子則相應地帶正電荷�。這樣一來,帶有一個電子空穴或一個自由電子對的物質(zhì)就可以與碳原子進行加成反應�。
如果鏈烯烴受到游離基化的作用,則只有一個π電子對的電子轉(zhuǎn)移到原來組成的雙鍵的碳原子上而無電荷變化����,其它游離基就能加成到這一雙游離基上。
方程式16和17就是離子型和游離基型加成反應的簡單原理:
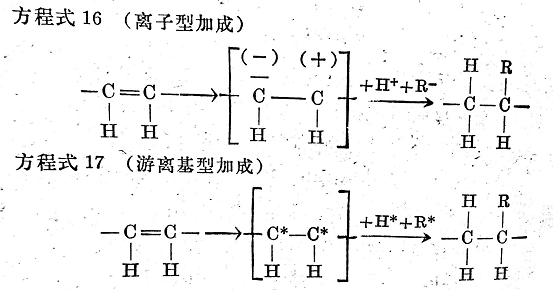
已經(jīng)說過�,活化硫黃既可以以離子的形式存在,也可以以游離基的形式存在��。這就意味著由于硫黃活化方式的不同��,高聚物鏈或者與硫黃進行離子化反應�,或者進行游離基反應���。后面將要看到����,這對進一步交聯(lián)反應和硫化膠的性能有相當大的影響。
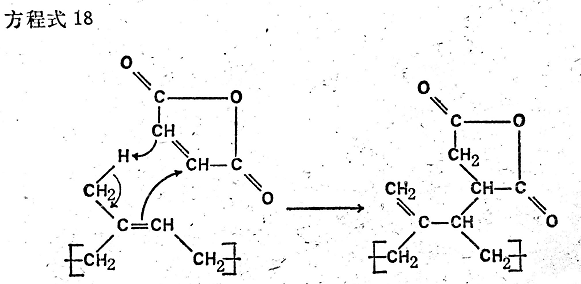
雙健可以參與的第三種類型的反應是已說過的“熱”或“極化”反應�,這種反應是在升高溫度的情況下進行的。曾經(jīng)詳細研究過的順丁烯二酸酐在聚異戊二烯上的加成反應就是例�����。這種反應在熱能的作用下既不以離子形式進行�,也不以游離基形式進行。其反應機理是由于結(jié)合電子的傳遞�,如方程式18所示。
這一反應的特征就是形成乙烯叉雙鍵側(cè)基�,而原來的雙鍵消失����。電子移動的方向由電子給予體甲基的作用所決定。由于橡膠錐中位置不同����,或者出現(xiàn)過剩電子,因而活化熱加成反應���,或者缺乏電子�����。
在硫化過程中雙鍵數(shù)目往往保持不變�。因此在初步反應中并不總是出現(xiàn)象方程式16和17那樣的雙鍵加成反應。反之往往在雙鍵α-位置����,而多數(shù)是在甲基一邊α-位置的次甲基上發(fā)生取代反應��,在這種情況下����,雙鍵在反應后仍然保留或者至多轉(zhuǎn)移到鄰近位置上去���。由于甲基的電子給予體的作用為雙鍵的親電子性能所過分補償,雙鍵旁邊的a-次甲基相對于甲基來說有很強的電子附聚作用,而使其特別活潑(舉例見2.3.2.2.2)�����。在沒有甲基作用的合成膠中,由于雙鍵的電子親合性或取代基諸如苯基的作用(結(jié)果相同)使次甲基中氫原子的鍵合強度增加147,以致活性下降�����。
雙鍵電子云由于極化而變形以后,反應物質(zhì)就可以結(jié)各到a-次甲基上�。離子取代反應一般是在脫氫后進行的,脫氫后產(chǎn)生負電荷,帶有電子空穴的取代物質(zhì)(如硫黃)很容易結(jié)合上去。硫黃的電子空穴可按方程式14的機理產(chǎn)生����。
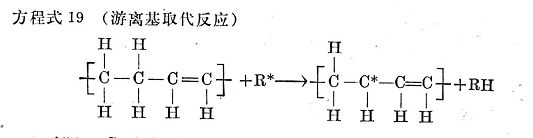
在游離基型的取代作用中,如方程式19所示,游離基可以將游離基狀態(tài)轉(zhuǎn)移給鏈烯烴,并由此發(fā)生進一步的交聯(lián)取代反應。
方程式19
例如,S8環(huán)按方程式14下半部分的反應進行裂解,所形成的雙游離基硫如與游離基碳原子反應,則雙游離基硫的個電子與碳原子的一個電子結(jié)合而形成C-S鍵(見方程式20),而另一端的硫原子仍保留著一個自由電子,這種游離基狀態(tài)(亦即活化狀態(tài))可以在取代之后繼續(xù)存在��。